1 –
RADIOATIVIDADE
Radioatividade é a emissão de radiação de um núcleo instável ao se transformar em outro núcleo.
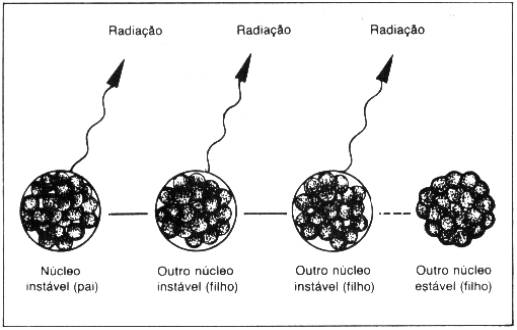
O núcleo instável se transforma em
outro núcleo (que é chamado por alguns núcleo
filho) que pode ou não ser instável. Caso seja instável, continuará se
transformando, até chegar a um núcleo estável.
A
radioatividade é um fenômeno nuclear, isto é, tem origem no núcleo do átomo. Ela
não é afetada por nenhum fator externo, como pressão, temperatura, etc.
2 – EVENTOS IMPORTANTES
NA DESCOBERTA DA RADIOATIVIDADE
1895 – Wilhelm Roentgen,
trabalhando com ampolas de Crookes, nas quais aplicava potenciais muito altos
entre os eletrodos, descobre uma radiação invisível. É a descoberta do Raio X.
1896 – Antonie Henri
Becquerel, trabalhando com fluorescência, descobre que o sulfato duplo de
urânio e potássio sensibiliza chapas fotográficas sem prévia excitação. É a
descoberta da radioatividade.
1897 – J. J. Thomson
descobre o elétron como constituinte do átomo.
1898 – Marie Slodowska Curie
descobre o polônio, trabalhando com a plechblenda, um minério de urânio.
Aparece o nome radioatividade e melhor fonte para seu estudo.
1898 – Marie e seu marido,
Pierre Curie, anunciam a descoberta de um novo elemento, o rádio, muitas vezes
mais radioativo que o urânio e até o próprio polônio. Porém o elemento foi
definitivamente isolado, por Marie, em 1910.
1899 – Ernest Rutherford
descobre uma emanação radioativa do tório.
1900 – Pierre Curie
classifica dois tipos de emanação do rádio, chamados alfa e beta.
1900 – Vilhard descobre um
terceiro tipo de emanação chamado gama.
3 – A
RADIOATIVIDADE NATURAL
Os estudos a respeito do fenômeno descoberto por Becquerel
em 1896 foram evoluindo. Em 1903, Ernest
Rutherford e Frederick Soddy
estabelecem três pontos importantes:
1)
Um
isótopo puro emite partícula a ou partícula b , nunca as duas simultaneamente.
2)
A
radioatividade envolve a desintegração
de átomos, isto é, a formação de diferentes tipos de matéria, incluindo átomos
de outros elementos que podem eventualmente ser radioativos.
3)
Uma
lei rege o decaimento radioativo: A
intensidade do decaimento é
proporcional à quantidade do elemento radioativo presente, e a fração do
elemento radioativo que sofre desintegração, num determinado intervalo de tempo,
é constante.
Um pouco mais tarde Soddy e alguns colaboradores (
Fajans e Russel ) propuseram o que chamaram
regras do decaimento, hoje conhecidas como leis da radioatividade:
1)
Na
emissão alfa, é produzido um novo núcleo com número atômico duas unidades menor
que o do núcleo emissor.
2)
Na
emissão beta, é produzido um novo núcleo com número atômico uma unidade maior
que o do núcleo emissor.
Podemos equacionar ( e verificar ) essas duas leis,
lembrando a notação usada na representação dos
isótopos:
|
massa relativa |
® |
A |
X |
|
|
|
|
|
||||
|
|
|
|
¬ |
Símbolo da partícula |
|
|
|
|
Z |
|||
|
carga relativa |
® |
|
|
Exemplo:
|
Partícula alfa |
4 |
a |
próton |
1 |
p |
|
2 |
1 |
||||
|
Partícula beta |
0 |
b |
elétron |
0 |
e |
|
-1 |
-1 |
||||
|
Raio gama |
0 |
g |
Nêutron |
1 |
n |
|
0 |
0 |
Os isótopos representados numa equação rádio-química
são chamados nuclídeos.
Equacionando as duas leis da
radioatividade:
1ª Lei:
|
A |
X |
® |
4 |
a |
+ |
A |
- |
4 |
Y |
|
Z |
2 |
Z |
- |
2 |
Observe:
· apareceu outro elemento
químico;
· o número atômico diminuiu 2
unidades;
· o número de massa diminuiu
4 unidades;
· houve conservação da massa
e da carga.
2ª Lei:
|
A |
X |
® |
0 |
b |
+ |
|
|
4 |
Y |
|
Z |
-1 |
Z |
+ |
2 |
Observe:
· apareceu outro elemento químico;
· o número atômico aumentou 1 unidade;
· o número de massa não variou ( \ X e Y são isóbaros );
· houve conservação da massa e da carga.
Lembre:
A partícula beta tem origem na
decomposição de um nêutron do núcleo, que assim pode ser equacionada:
|
1 |
n |
® |
1 |
p |
+ |
0 |
b |
+ |
0 |
v ( neutrino ) |
|
0 |
1 |
-1 |
0 |
A partícula beta é o elétron que é
imediatamente expulso do núcleo.
O neutrino é uma partícula sem carga e
com massa despresível.
4
– ASPECTOS QUANTITATIVOS DA RADIOATIVIDADE
Resumindo algumas das conquistas nos
estudos dos aspectos quantitativos no campo da radioatividade, não vamos nos
preocupar com demonstrações, mas com os resultados.
4.1) Constante Radioativa ( k ) –
A velocidade ( v ) do decaimento
radioativo ( desintegração radioativa ) de um determinado isótopo é diretamente
proporcional ( k ) ao número de átomos ( N0 ) desse isótopo na
amostra.
v
= k N0
k
= Constante Radioativa ou de Desintegração
A constante radioativa representa a
fração de átomos que se desintegra na unidade de tempo.
A constante possui um valor
característico para cada isótopo radioativo.
Por exemplo, a constante de
desintegração do 226Ra é 1/2300 ano -1,
isto é, em cada 2300 átomos desse isótopo, um se desintegra no espaço de um
ano.
4.2) Vida-média ( Vm ) –
O inverso da constante radioativa é
chamado vida-média.
Vm = 1/k
Por exemplo, a vida-média do isótopo
226 do rádio é 2300 anos.
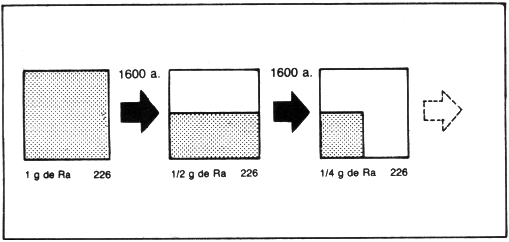
4.3) Meia-vida ou período de semidesintegração ( t1/2 ou
P ) –
O tempo necessário para que metade de
uma amostra de um isótopo radioativo se desintegre é chamado meia-vida ou período de semidesintegração.
Por exemplo, o isótopo 226 do rádio tem
meia-vida igual a 1600 anos.
5
– TRANSMUTAÇÃO ARTIFICIAL
Com o desenvolvimento do estudo da
radioatividade natural, novos horizontes foram surgindo, e as primeiras
tentativas no sentido da sua obtenção artificial foram realizadas.
Tudo indica que a primeira transmutação artificial coroada de
êxito é devida a Ernest Rutherford, que bombardeou
gás nitrogênio com partículas a:
|
14 |
N |
+ |
4 |
a |
® |
17 |
O |
+ |
1 |
H |
|
7 |
2 |
8 |
1 |
Essa primeira reação nuclear artificial
acumula também a importância de ser a descoberta do próton.
A descoberta do nêutron é outro exemplo
de transmutação artificial: foi realizada, em 1932, por James Chadwick, que
bombardeou berílio com partículas a:
|
9 |
Be |
+ |
4 |
a |
® |
12 |
C |
+ |
1 |
N |
|
4 |
2 |
6 |
0 |
As experiências com radioatividade
artificial mostraram, entre outras coisas, a necessidade de fontes convenientes
de “ projéteis “ de alta energia. Assim, em 1929, aparece o primeiro acelerador de partículas, que
proliferou nos centros científicos que desenvolviam as experiências de transmutação.
Esse avanço possibilitou, entre outras,
uma evolução importante na descoberta de novos elementos. Até 1940 só
conhecíamos até o elemento de número atômico 92, isto é, o urânio.
Em 1940 McMillam e Abelson produzem o
netúnio ( Z=93 ) pelo bombardeamento do U238 com um feixe de
dêuterons ( núcleos de deutério ) de alta energia.
|
238 |
U |
+ |
2 |
H |
® |
239 |
Np |
+ |
1 |
H |
+ |
0 |
e |
|
92 |
1 |
93 |
1 |
-1 |
6
– RADIOATIVIDADE ARTIFICIAL
É a radioatividade de isótopos
radioativos artificiais, isto é, isótopos formados nas transmutações
artificiais. Os isótopos radioativos artificiais, além de emitirem raios alfa,
beta e gama, podem também emitir os raios beta positivos ou pósitrons (
partículas com carga dos prótons e a massa dos elétrons ).
A radioatividade artificial foi
descoberta em 1932 pelo casal Frederic Jolliot Curie e Irene ( filha dos
descobridores do urânio e rádio ).
É a radioatividade artificial, hoje, um
campo em grande desenvolvimento. Para se ter uma idéia, conhecemos atualmente
um total de 1500 isótopos dos quais 1200 são artificiais.
7
– FISSÃO NUCLEAR
No campo da radioatividade artificial,
foi uma importante conquista. A descoberta desse fenômeno se deve aos trabalhos
de Enrico Fermi, Otto Hahn e Lise Meitner, e acaba envolvendo um grande número
de cientistas de primeiro escalão do século XX.
Ela consiste no bombardeamento adequado
de um núcleo pesado que, atingido, fragmenta-se em outros núcleos menores e
algumas partículas.
A mais conhecida das reações de fissão
nuclear é a do 238U, usada na bomba atômica lançada em Hiroshima, em
agosto de 1945:
|
238 |
U |
+ |
1 |
n |
® |
140 |
Ba |
+ |
94 |
K |
+ 2 |
1 |
n + Energia |
|
92 |
0 |
56 |
36 |
0 |
A reação produz, além de Ba e Kr, dois
nêutrons capazes de realizar a fissão em dois outros núcleo, e assim por
diante: uma reação em cadeia que libera uma assustadora energia.
Em 1942, o próprio Enrico Fermi dá o
passo inicial para uma importante aplicação da fissão nuclear, construindo o primeiro reator atômico. A partir daí, uma grande variedade de reatores
aparece com o intuito de fornecer aplicação pacífica dessa enorme energia do
núcleo do átomo.
8
– FUSÃO NUCLEAR
É o processo em que núcleos pequenos se
juntam, originando núcleos maiores e mais estáveis, daí uma liberação
gigantesca de energia.
Um conhecido exemplo de fusão nuclear é
dado pela síntese do hélio na superfície do sol:
|
4 |
1 |
H |
® |
4 |
He |
+ |
2 |
0 |
e + Energia |
|
1 |
2 |
+1 |
Na década de 1940, Edward Tellep, com
seus colaboradores, consegue realizar essa reação no laboratório em Los Alamos,
o que tornou “ o pai da bomba H “.
Hoje caminhamos a passos largos para a
aplicação pacífica desse processo.
9
– APLICAÇÕES DA RADIOATIVIDADE
As aplicações da radioatividade são
incontáveis, sendo que muitas delas ainda estão em desenvolvimento e novas
provavelmente serão encontradas.
Para que se tenha u ma pálida idéia
dessas reações:
· Usam-se amostras
radioativas para a diagnose, na medicina terapêutica. Um bom exemplo é a
aplicação do I131 nos exames rotineiros de tireóide, como na terapia
do bócio maligno.
· Datamento radioativo.
Algumas transformações radioativas são adequadamente utilizadas para o “
cálculo “ da idade de determinados materiais. Por exemplo, a proporção C14/C12
numa amostra pode dar sua idade. Para rochas antigas, a relação K40/Ar40
ou a relação Rb87/Sr87 pode indicar a sua idade, o que
foi feito com amostras de rochas lunares recolhidas pelos astronautas da Apolo.
· O cobalto 60 é usado na
teraía do câncer.
Por:
|
Caio
Giannone |
Nº |
: |
05 |
||
|
Série |
: |
3º
EMC |
|
||